Hoe dringt een virus de cel binnen? Onthulling van een 'zoet geheim'
Onderzoekers van de Universiteit Utrecht hebben een vernuftig mechanisme ontdekt dat spike-eiwitten van een coronavirus activeert om aanhechting aan en binnendringen van gastheercellen mogelijk te maken. Het onderzoek, gepubliceerd in het toonaangevende wetenschappelijke tijdschrift Nature, maakte gebruik van geavanceerde (cryogene elektronen) microscopie en computersimulaties. De resultaten laten zien hoe de binding aan een piepklein suikermolecuul een keten van ingrijpende veranderingen in de ruimtelijke structuur van een coronavirus-spike-eiwit in gang zet. Als gevolg hiervan komt een tot dan toe verborgen tweede receptorbindingsdomein beschikbaar. Deze bevindingen bieden nieuwe, fundamentele inzichten in de complexe mechanismen die coronavirussen gebruiken om het immuunsysteem te omzeilen en infecties te veroorzaken.
De allereerste en allesbepalende stap van een virale infectie is aanhechting van het virus aan de gastheercel. De eiwitten, waarmee virussen binden aan receptoren op het celoppervlak, zijn daarom een effectief doelwit voor het immuunsysteem. Zo is ook bij coronavirussen het spike-eiwit, en dan met name het receptorbindingsdomein, een achilleshiel. Antilichamen, die aan dit domein binden, inactiveren het virus.
Eerder werd voor de meest beruchte coronavirussen – de virussen die SARS, MERS en COVID-19 veroorzaken – gevonden dat zij aan detectie door neutraliserende antilichamen proberen te ontsnappen, door het receptorbindingsdomein in het spike-eiwit te verbergen en af en toe spontaan te laten zien. Je zou dan verwachten dat dit voor alle coronavirussen het geval is. Maar de spike-eiwitten van vrijwel alle andere tot dusver bestudeerde menselijke en dierlijke coronavirussen zijn uitsluitend gevonden in gesloten ‘potdichte’ toestand, dat wil zeggen met het receptorbindingsdomein verborgen.
Hoe kan dat? Een mogelijkheid is dat de spike-eiwitten van deze coronavirussen niet zomaar willekeurig van de ene naar de andere (van gesloten naar open) toestand overschakelen, maar dat er wellicht specifieke biologische signalen zijn die ervoor zorgen dat ze opengaan op de juiste plek en op het juiste moment.
De aanhechting van coronavirussen is mogelijk nog ingewikkelder en geraffineerder dan we tot nu toe dachten
Om dit te onderzoeken, richtten hoofdauteurs Raoul de Groot en Daniel Hurdiss (Universiteit Utrecht, faculteit Diergeneeskunde, afdeling virologie) zich op het spike-eiwit van het menselijke coronavirus HKU1, dat net als de meeste spike-eiwitten slechts in gesloten toestand was waargenomen. HKU1 is een verkoudheidsvirus en veroorzaakt samen met drie andere humane coronavirussen (OC43, NL63 en 229E) naar schatting vijftien tot dertig procent van de luchtweginfecties per jaar. Eerder onderzoek toonde aan dat infectie door HKU1 kritisch afhankelijk is van binding aan een specifiek suikermolecuul dat voorkomt op het celoppervlak (als onderdeel van de suikerketens van zogenoemde glycolipiden die deel uitmaken van de celmembraan).
Slim afgestelde suikerschakelaar
In het huidige onderzoek ontdekten de auteurs dat binding aan dit suikermolecuul leidt tot grote veranderingen in de ruimtelijke structuur van het spike-eiwit, waardoor er een eerder verborgen receptorbindingsdomein vrijkomt. Dit maakt binding mogelijk aan een tweede receptor, wat weer nodig zou zijn voor de vervolgstappen: fusie tussen de virale envelop en de celmembraan en het daarmee inbrengen van het virale genetische materiaal in de gastheercel. De Utrechtse onderzoekers vonden dus een biomoleculair mechanisme dat tot nu toe onbekend was voor de wetenschap. "Het is een slim afgestelde suikerschakelaar", zegt Hurdiss. "Vanuit het perspectief van de virussen is het een uitgekiende manier om je achilleshiel, het domein waaraan de receptor bindt, verborgen te houden tot het meest geschikte moment. Onze bevindingen schetsen een completer beeld van de aanhechting van coronavirussen, met mogelijkheden van dubbel receptorgebruik als middel om aan het immuunsysteem te ontsnappen."
“Je zou overigens kunnen tegenwerpen dat het virus hiermee het probleem heeft verlegd”, merkt de Groot op, “van de tweede receptorbindingsplaats naar de eerste. Maar receptorbindingsdomeinen voor suikerbinding zijn plastischer dan die voor eiwitten. Mutaties in dergelijke domeinen lijken minder snel te leiden tot functieverlies, dat wil zeggen verlies van de mogelijkheid tot aanhechting. Daardoor is het voor het virus wellicht makkelijker te ontsnappen aan het immuunsysteem door middel van antigene variatie.”
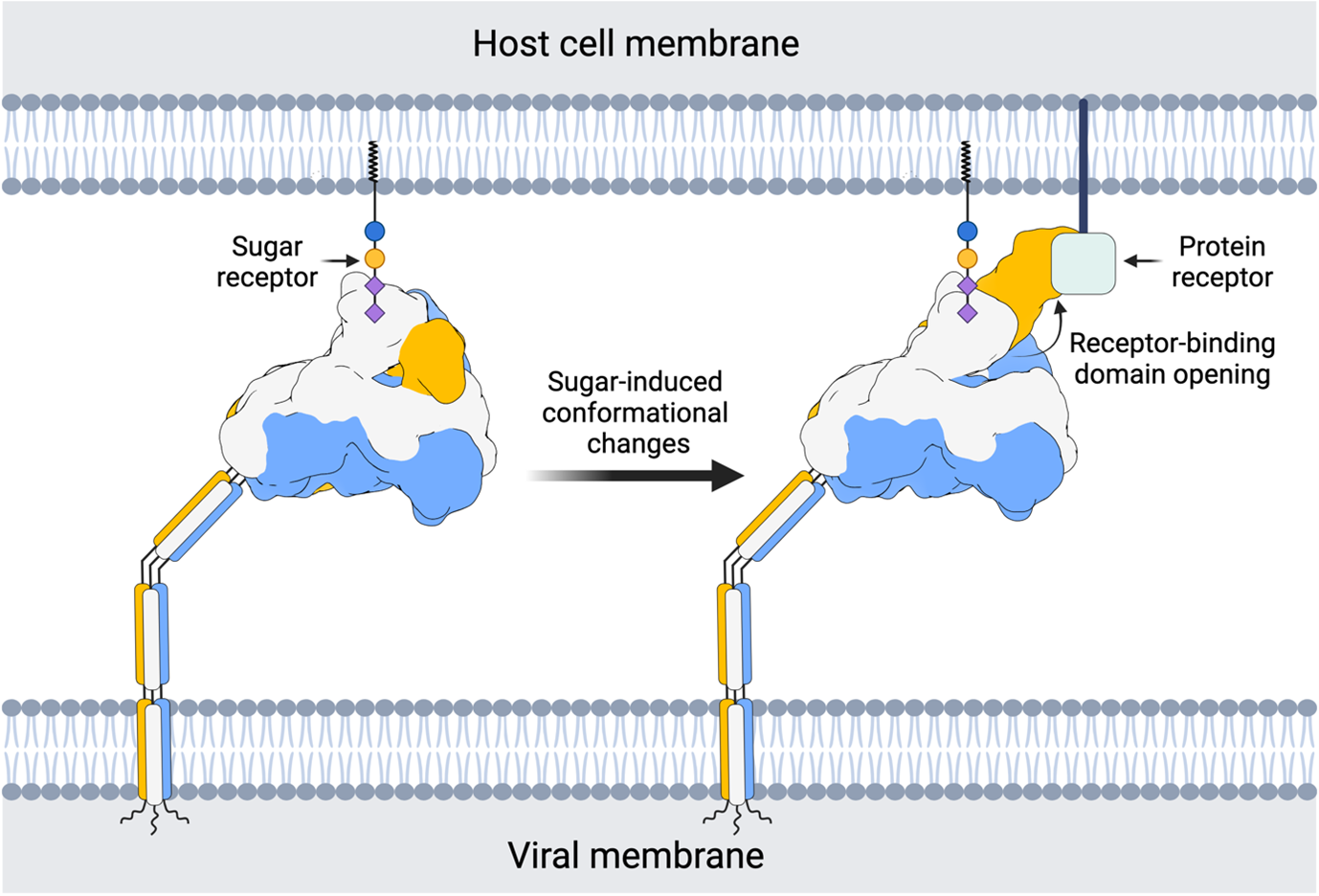
Kettingreactie van aanpassingen
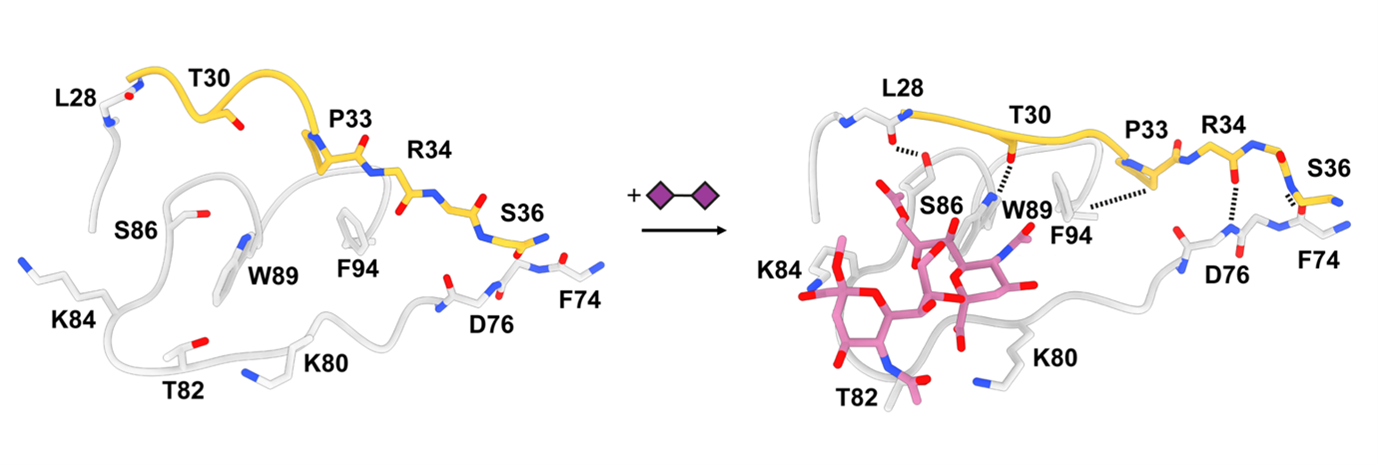
Matti Pronker (Universiteit Utrecht, faculteit Bètawetenschappen en eerste auteur van het onderzoek) modelleerde elke verandering van de spike en leidde daaruit een stapsgewijze reeks gebeurtenissen af die worden veroorzaakt door suikerbinding. In samenwerking met Robert Creutznacher (Universiteit Utrecht, faculteit Diergeneeskunde) en Martin Frank, computationeel chemicus van Biognos AB, kon hij een atomistische verklaring geven voor hoe een piepklein suikermolecuul een kettingreactie van stucturele veranderingen veroorzaakt in dit reusachtige macromoleculaire complex. "Het is een soort vlindereffect", zegt Pronker, refererend naar een begrip uit de chaostheorie. "Het was intrigerend om te zien hoe kleine en lokale veranderingen, in gang gezet door de suikerbinding, grotere domeinbewegingen en uiteindelijk opening van het spike-eiwit in gang zetten."
Sesam open u!
"Jarenlang onderzoek naar de interacties tussen coronavirussen en suikers heeft geleid tot dit werk", zegt De Groot. "Het was bovenal een gezamenlijke multidisciplinaire inspanning, waarbij we hebben geprofiteerd van de unieke expertise van Geert-Jan Boons en Martin Frank, en waarbij Yifei Lang, Zeshi Li en Ruben Hulswit de basis hebben gelegd. Onze bevindingen suggereren dat aanhechting van coronavirussen niet een eenvoudige kwestie is van binding aan één type receptor, maar dat in sommige (en, wie weet, misschien wel de meeste) gevallen er sprake is van achtereenvolgende aanhechting aan verschillende receptoren alvorens het virus toegang krijgt tot de cel. Bij de virologiegroep is verder onderzoek in volle gang om te begrijpen hoe coronavirussen cellen infecteren. Dergelijke studies zijn van belang voor het begrijpen van interacties tussen virus en gastheer, voor het ontwikkelen van vaccins en antivirale middelen en niet in de laatste plaats, om inzicht te krijgen hoe coronavirussen van dier op mens worden overgedragen. "

