
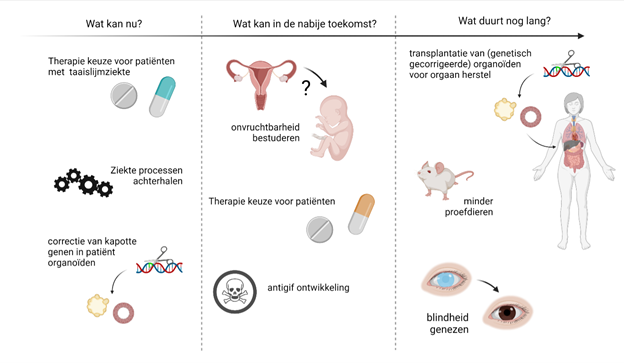
Waar kun je organoïden voor gebruiken?
Inmiddels kunnen van veel organen organoïden gemaakt worden. Onderzoekers gebruiken deze organoïden nu al om de werking van ziektes te bestuderen. Door organoïden van zieke en gezonde organen met elkaar te vergelijken komen ze er bijvoorbeeld achter welke processen er verschillend zijn. Waar worden organoïden verder nog voor gebruikt, en wat zijn de beperkingen?
Er loopt veel onderzoek om te kijken waar organoïden voor gebruikt kunnen worden. Denk daarbij bijvoorbeeld aan het testen van medicijnen, het vervangen van organen, het ontwikkelen van antigif, en onderzoek naar onvruchtbaarheid of gentherapie voor zieke organen. Hieronder staan een paar voorbeelden uitgebreider toegelicht.
Testen van medicijnen
Sommige organoïden zijn al geschikt voor het testen van medicijnen. Zo gebruiken onderzoekers en artsen samen al darmorganoïden om de best werkende medicijnen voor individuele patiënten met taaislijmziekte of kanker te kiezen. Dit zijn ziektes met veel verschillende vormen, en het is niet altijd duidelijk welke vorm een patiënt heeft en of een medicijn bij diegene zal werken. Maar het is bewezen dat organoïden hetzelfde op de medicijnen reageren als mensen.
Voordelen van medicijntesten op organoïden
Door organoïden in te zetten kun je dus kleine hoeveelheden van de medicijnen tegelijk testen en zo snel en veilig te weten komen of een medicijn werkt bij een patiënt. Dit is beter voor de patiënt omdat deze direct het meest geschikte medicijn krijgt. Ook is dit beter voor de maatschappij omdat er minder vaak vergeefs van de dure medicijnen gebruik gemaakt wordt. Op termijn kan dit er ook voor zorgen dat er veel minder proefdieren nodig zijn voor het onderzoek naar medicijnen.
Kunnen organoïden organen vervangen?
De transplantatie van organoïden, als alternatief voor orgaandonatie of om kleine stukken weefsel te herstellen, kan op termijn een mogelijkheid zijn. Leverorganoïden zijn bijvoorbeeld al succesvol in de lever van kleine dieren getransplanteerd. Ook darmorganoïden zijn al gebruikt om de darmwand van muizen te repareren. Maar dit is dus nog niet in mensen toegepast, en eerst zal duidelijk moeten zijn in hoeverre de transplantaties de orgaanfunctie hersteld hebben, en of de organoïden ook maanden later nog in het orgaan zitten.
Een eerste stap richting transplantaties in de mens wordt gezet. Onderzoekers en artsen in Groningen beginnen in 2022 met de transplantatie van speekselklierorganoïden in kankerpatiënten. Deze therapie moet de speekselklieren die tijdens chemotherapie zijn vernietigd weer regenereren.
Een andere toepassing met veel potentie zijn netvliesorganoïden die in knaagdieren op de goede plek in de ogen terecht kwamen en het gezichtsvermogen van de dieren verbeterden. Voorlopig zullen er echter nog geen transplantaties in mensen gedaan worden.
We kunnen sommige organoïden nu al gebruiken voor het testen van medicijnen of om te kijken hoe ziektes ontstaan.
Antigif ontwikkeling
Het is mogelijk om ook van andere dieren dan mensen organoïden te maken. Zo kunnen onderzoekers ook organoïden van de gifklieren van slangen maken. Met deze gifklierorganoïden kunnen onderzoekers de aanmaak van het gif beter begrijpen, en dat kan er hopelijk voor zorgen dat er in de toekomst makkelijker en sneller antigif gemaakt kan worden.
Wat kunnen we in de toekomst verwachten?
Voor sommigen organoïden, zoals van het netvlies, de lever of darm, wordt aan de vervanging van delen van het orgaan gewerkt. De visie is om patiënt-eigen organoïden terug in het lichaam te plaatsen om de defecte delen van het orgaan te herstellen.
Bij genetische defecten zullen de organoïden eerst genetisch gecorrigeerd worden en daarna terug in het lichaam worden geplaatst. Een groot voordeel hiervan is dat dure en levenslange geneesmiddelen om afstoting van het nieuwe “orgaan” tegen te gaan dan niet nodig zijn. Onduidelijk is op welke termijn dergelijke behandelingen toepasbaar worden, omdat veel biologische en ethische vragen nog onbeantwoord zijn.
In plaats van orgaantransplantatie zijn organoïden in de nabije toekomst eerder geschikt voor gepersonaliseerd geneesmiddelenonderzoek.
Wat beperkt het gebruik van organoïden?
Organoïden types zoals baarmoederslijmvlies organoïden staan nog in de kinderschoenen. Dit is omdat deze organoïden nog niet alle functies van het baarmoederslijmvlies hebben. Wetenschappers onderzoeken bij deze organoïden nog hoe ze de baarmoederslijmvlies functies kunnen verbeteren om in de toekomst onder andere onvruchtbaarheid te kunnen bestuderen.
Voor veel andere type organoïden geldt hetzelfde: de organoïden hebben nog niet alle nodige functies van een orgaan voor toepassingen zoals transplantatie of geneesmiddelenonderzoek. Het lijkt erop dat de signalen die in het lab aan de organoïden worden gegeven niet voldoen om alle functies te bevorderen.
Verder lezen over onderzoek
 Kunnen modellen zoals organen-op-chips proefdieren vervangen? Om de gezondheid van mens en dier te blijven verbeteren, ontwikkelen onderzoekers alternatieven voor proefdieren, zoals organ-on-a-chip modellen.
Kunnen modellen zoals organen-op-chips proefdieren vervangen? Om de gezondheid van mens en dier te blijven verbeteren, ontwikkelen onderzoekers alternatieven voor proefdieren, zoals organ-on-a-chip modellen. Waar kun je stamcellen voor gebruiken? Stamcellen kun je gebruiken om te snappen hoe ziektes ontstaan, om patiënt-specifieke medicijnen te testen en om patiënt-specifieke vervangende organen te kweken.
Waar kun je stamcellen voor gebruiken? Stamcellen kun je gebruiken om te snappen hoe ziektes ontstaan, om patiënt-specifieke medicijnen te testen en om patiënt-specifieke vervangende organen te kweken. Hoe maak je een organoïde? Organoïden worden gemaakt van stamcellen van patiënten. Door het lichaam na te bootsen groeien stamcellen uit tot een soort mini-orgaantje.
Hoe maak je een organoïde? Organoïden worden gemaakt van stamcellen van patiënten. Door het lichaam na te bootsen groeien stamcellen uit tot een soort mini-orgaantje. Waar kun je organoïden voor gebruiken? Organoïden worden gebruikt om de werking van ziektes te bestuderen, maar ook om medicijnen te testen op een patiënt-specifieke manier.
Waar kun je organoïden voor gebruiken? Organoïden worden gebruikt om de werking van ziektes te bestuderen, maar ook om medicijnen te testen op een patiënt-specifieke manier. Is 3D-bioprinten niet heel kostbaar? Wie betaalt de rekening en is het dan niet enkel beschikbaar voor de rijken? Hoge kosten van nieuwe technologieën kunnen zorgen oproepen over (toenemende) sociale ongelijkheid.
Is 3D-bioprinten niet heel kostbaar? Wie betaalt de rekening en is het dan niet enkel beschikbaar voor de rijken? Hoge kosten van nieuwe technologieën kunnen zorgen oproepen over (toenemende) sociale ongelijkheid. Welke opleiding kan ik volgen om RM-onderzoeker te worden? Nieuwsgierig naar een carrière in de regeneratieve geneeskunde? Lees welke opleiding(en) je kunt volgen en wat de loopbaanmogelijkheden zijn.
Welke opleiding kan ik volgen om RM-onderzoeker te worden? Nieuwsgierig naar een carrière in de regeneratieve geneeskunde? Lees welke opleiding(en) je kunt volgen en wat de loopbaanmogelijkheden zijn. Wat doet een RM-onderzoeker? Wat doen onderzoekers in de regeneratieve geneeskunde eigenlijk, en hoe werken verschillende vakgebieden in dit veld samen?
Wat doet een RM-onderzoeker? Wat doen onderzoekers in de regeneratieve geneeskunde eigenlijk, en hoe werken verschillende vakgebieden in dit veld samen? Waarom duurt het zo lang voordat behandelingen voor patiënten beschikbaar komen? Voordat een ATMP in de reguliere gezondheidszorg beschikbaar is voor patiënten, gaat er vaak wel 10 tot 20 jaar overheen. Waarom duurt dat zo lang?
Waarom duurt het zo lang voordat behandelingen voor patiënten beschikbaar komen? Voordat een ATMP in de reguliere gezondheidszorg beschikbaar is voor patiënten, gaat er vaak wel 10 tot 20 jaar overheen. Waarom duurt dat zo lang?
Bronnen:
- Wetenschappelijk artikel van M. Boretto et al. (2017) over de ontwikkeling van baarmoederorganoïden (in het Engels)
- Wetenschappelijk artikel van J.F. Dekkers et al. (2013) over het gebruik van darmorganoïden om taaislijmziekte te bestuderen (in het Engels)
- Wetenschappelijk artikel van M. Fathi et al. (2021) over netvliesorganoïden (in het Engels)
- Wetenschappelijk artikel van Z.Y. Gu et al. (2020) over darmorganoïden als ziektemodel (in het Engels)
- Wetenschappelijk artikel van J.H. Jee et al. (2021) over transplantatie van darmorganoïden in muizen (in het Engels)
- Wetenschappelijk artikel van J. Kim et al. (2020) over organoïden van menselijk weefsel als ziektemodel (in het Engels)
- Wetenschappelijk artikel van A. Luddi et al. (2020) over darmorganoïden als ziektemodel (in het Engels)
- Wetenschappelijk artikel van Y. Post et al. (2020) over organoïden van gifklieren van slangen (in het Engels)
- Wetenschappelijk artikel van F. Sampaziotis et al. (2021) over organoïden van de galwegen (in het Engels)
- Wetenschappelijk artikel van I.J. Schurink et al. (2021) over leverorganoïden (in het Engels)
- Wetenschappelijk artikel van T. Tsuchida et al. (2020) over transplantatie van leverorganoïden in diermodellen (in het Engels)


