Nieuwe methode om in te zoomen op de poortwachter van het genoom
Publicatie in Angewandte Chemie
Onderzoekers van de Universiteit Utrecht hebben een breed inzetbare methode ontwikkeld om inzicht te krijgen in de binding van eiwitten aan chromatine op atomair niveau. Chromatine is het complex van DNA en eiwitten in de cel dat zowel tijdens de ontwikkeling als tijdens het leven van de cel alles reguleert wat met DNA moet gebeuren. Helemaal nieuw is dat de methode ook inzicht geeft in wat die binding betekent voor de bewegingsvrijheid van het eiwit en het plaatselijke stukje chromatine. “Over de precieze werking van deze fundamentele laag in de biologie weten we nog heel weinig, omdat het zo’n complex systeem is”, aldus onderzoeksleider dr. Hugo van Ingen van de Universiteit Utrecht. De methode is gepubliceerd in het wetenschappelijke tijdschrift Angewandte Chemie.
Chromatine is de poortwachter tot het genoom: het biedt of weigert eiwitten toegang tot het DNA en stuurt daardoor de processen in de cel. Een doorgelaten eiwit bindt op een specifieke plek aan de chromatine waardoor bijvoorbeeld een gen wordt aan- of uitgeschakeld of DNA-schade wordt gerepareerd. “Vanuit het farmaceutisch onderzoek is veel interesse in dit soort bindingsprocessen, omdat die ook een ingang zijn voor nieuwe geneesmiddelen. Tot nu toe weten we echter nog maar van enkele eiwitten hoe hun binding aan chromatine eruitziet”, licht Van Ingen toe.
NMR vingerafdruk van nucleosomen
De onderzoekers zoomen met hun methode in op de individuele basiseenheden van chromatine, de nucleosomen. Die worden in een oplossing gemengd met het te onderzoeken eiwit, waardoor deze een binding aangaan. Vervolgens worden nucleosoom-eiwit complexen in een centrifuge op elkaar gestapeld tot een zeer compact monster, dat vergelijkbaar is met chromatine in de cel. Ter vergelijking wordt ook een monster gemaakt van nucleosomen zonder het eiwit. Met NMR-spectroscopie, een MRI-scanner voor moleculen, wordt van beide monsters een ‘vingerafdruk’ van het molecuul gemaakt. De verschillen tussen de twee vingerafdrukken laten zien hoe het eiwit aan het nucleosoom gebonden is.
Echte onderzoekswerk kan beginnen

Voor deze ‘proof of principle’ van de techniek zijn de Utrechtse onderzoekers uitgegaan van een viraal eiwit waarvan al bekend is hoe dit aan het nucleosoom bindt. Het onderzoekswerk naar de vele eiwitbindingen waarover nog weinig of niks bekend is, gaat nu beginnen. “Onze methode stelt minimale eisen aan de te bestuderen eiwitten, waardoor we verwachten dat die breed inzetbaar is. Bovendien gaat het relatief snel, nu het leeuwenwerk qua onderzoeksmethode gedaan is. Hierdoor kunnen we het onderzoek uitbreiden naar studies aan strengen van nucleosomen, als modellen voor de chromatinevezels in de cel.”
Pioneerfactoren
Van Ingen hoopt daarnaast door een combinatie van de nieuwe methode met NMR-studies in oplossing, te kunnen inzoomen op de specialisatie van stamcellen. Ook dit begint met de binding van bepaalde eiwitten, pioneerfactoren genoemd, aan nucleosomen. Die bepalen of een stamcel zich ontwikkelt tot bijvoorbeeld een levercel, een spiercel of een hartcel. Inzicht in dit proces zou kunnen leiden tot een betere methode om stamcellen te maken uit gewone cellen.
Onderzoeksmethode en resultaten
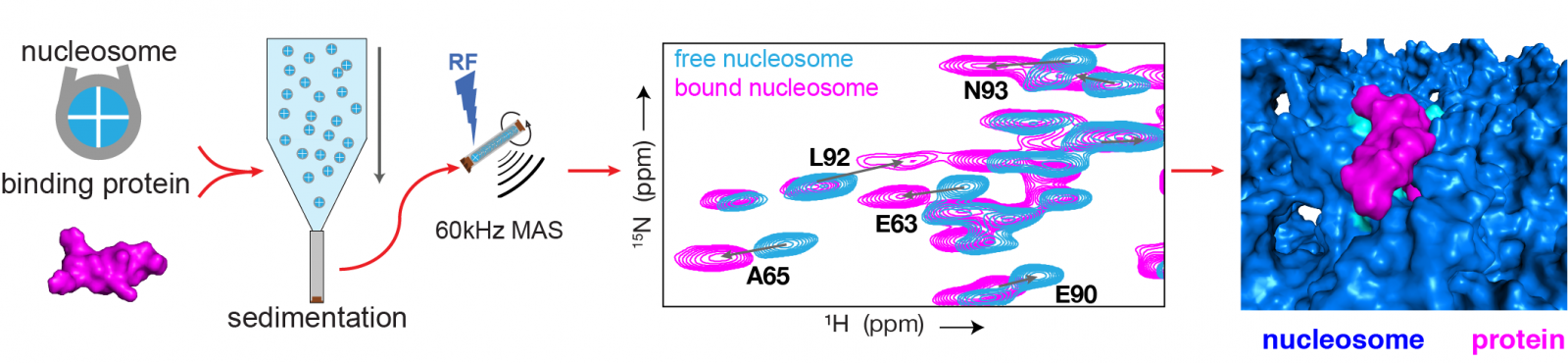
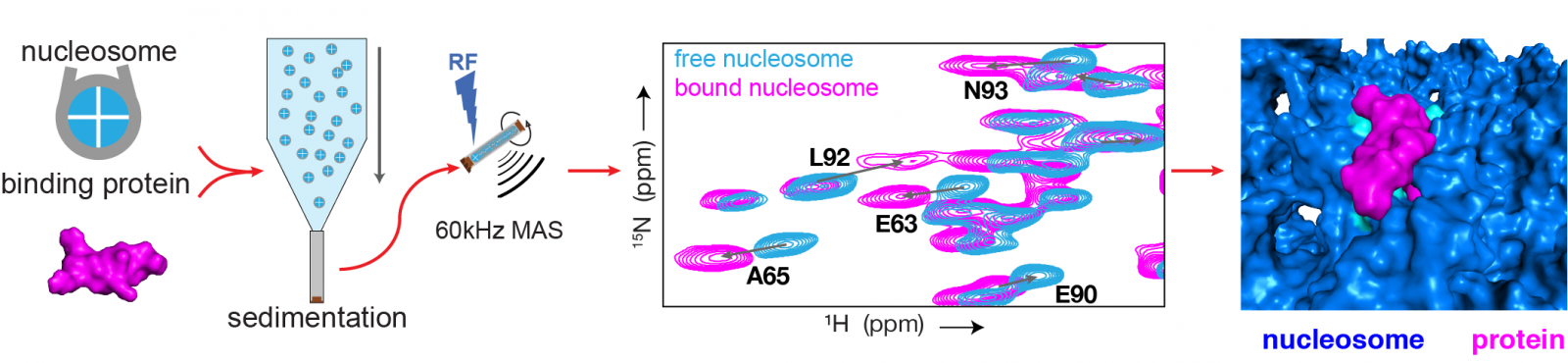
Schematische weergave van de onderzoeksmethode (linkerhelft) en een voorbeeld van de resultaten (rechterhelft). (1) Eerst worden monsters gemaakt van nucleosoom-eiwit complexen en complexen van alleen het nucleosoom. (2) Beide worden onderzocht met state-of-the-art NMR technieken. (3) Dit levert het ‘vingerafdrukken’-spectrum op, waarin de blauwe vlekken van het nuclesoom zonder en de roze van het nucleosoom met gebonden eiwit zijn. Iedere vlek in het spectrum is een piek en correspondeert met één aminozuur in het eiwit. De hoge resolutie van het spectrum maakt het mogelijk om voor iedere piek de verschillen tussen nucleosoom met en zonder eiwit te bepalen. (4) Uit deze verschillen wordt berekend hoe de binding van het eiwit aan het nucleosoom precies plaatsvindt.
Dit onderzoek is een samenwerking tussen de groepen van Hugo van Ingen (vloeistof NMR Spectroscopie) en prof. Marc Baldus (vaste stof NMR Spectroscopie), beiden van de Universiteit Utrecht. Het onderzoek is medegefinancierd door NWO (Vidi Hugo van Ingen).
Video ‘Wat is NMR?’
Publicatie
Site‐Specific Studies of Nucleosome Interactions by Solid‐State NMR Spectroscopy
Dr. ShengQi Xiang#, Ulric B. le Paige#, Velten Horn, Dr. Klaartje Houben, Prof.Dr. Marc Baldus, Dr. Hugo van Ingen; alle auteurs zijn verbonden aan de Universiteit Utrecht
Angewandte Chemie, maart 2018, https://doi.org/10.1002/anie.201713158
# equal contributions
Science for Life
Dit onderzoek maakt deel uit van interdisciplinaire onderzoeksprogramma Life Sciences van de Universiteit Utrecht, in het bijzonder van Science for Life.

