Toegangspoort tot lichaamscel nauwkeurig in beeld gebracht
Publicatie in Nature
Wetenschappers hebben opgehelderd hoe een kanaal in menselijke lichaamscellen zich opent en weer sluit. Dit kanaal, een membraaneiwit, functioneert als een soort toegangspoort die bepaalt welke ionen wel of niet de cel mogen betreden of verlaten. Samen met onderzoekers van de Oregon Health & Science University en de universiteit van Illinois onderzocht scheikundige Wout Oosterheert, promovendus bij de Universiteit Utrecht, de moleculaire structuur van dit membraaneiwit, dat een mogelijk doelwit is voor de ontwikkeling van medicijnen. De publicatie verschijnt vandaag in Nature.
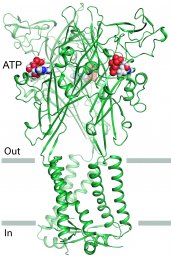
Het membraaneiwit waar Oosterheert zijn vizier op richtte is het P2X3-eiwit. Deze receptor is aanwezig in het menselijk lichaam en zit onder andere in zenuwcellen, en in cellen van het hart en het afweersysteem. Daar vormt het een kanaal in het celmembraan. Dit kanaal kan ionen zoals natrium en calcium van buiten naar binnen de cel verplaatsen. Een soort poort (de gate) in het eiwit bepaalt of deze deeltjes wel of niet doorgelaten worden.
Openen en sluiten
Het onderzoek waar Oosterheert aan deelnam heeft nu precies laten zien hoe de poort van het kanaal vanuit een rusttoestand wordt geopend doordat adenosinetrifosfaat (ATP) aan de receptor bindt. Ook werd zichtbaar hoe de poort vervolgens weer sluit via een alternatief mechanisme. Daarnaast hebben de onderzoekers bepaald hoe enkele stoffen de rusttoestand van P2X3 kunnen stabiliseren en daarmee voorkómen dat het kanaal wordt geopend. Deze remmers of antagonisten doen de poort als het ware op slot.
Niet stabiel
Om de moleculaire structuur van de receptor in verschillende toestanden te bepalen – in rust, geopend en op slot – gebruikten Oosterheert en collega’s röntgenkristallografie. Bij deze techniek worden kristallen van het P2X3-eiwit beschoten met röntgenstraling, waarna uit het verstrooiingspatroon de structuur kan worden opgehelderd. “Het bestuderen van membraaneiwitten zoals P2X3 is erg lastig omdat ze buiten hun natuurlijke omgeving niet stabiel zijn”, vertelt Oosterheert. “Daarnaast was het nog niet zo gemakkelijk om het eiwit in de specifieke toestanden te isoleren. Ik heb een speciale methode ontwikkeld om de P2X3-receptor te zuiveren waardoor het mogelijk werd om de moleculaire architectuur in de rusttoestand te bepalen.” Hij voerde dit onderzoek uit toen hij als Masterstudent Molecular & Cellular Life Sciences zeven maanden werkte in het lab van professor Eric Gouaux aan de Oregon Health & Science University in Portland.
Stimulans
Oosterheert verwacht dat de resultaten een stimulans zijn voor verder farmacologisch onderzoek. “De zogenaamde gating cycle van dit membraaneiwit is nu opgelost. We weten hoe de poort van dicht naar open en weer dicht gaat. Dat is van groot belang om dit soort eiwitten fundamenteel te begrijpen.”
Publicatie
X-ray structures define human P2X3 receptor gating cycle and antagonist action.
Steven E. Mansoor,Wei Lü, Wout Oosterheert*,Mrinal Shekhar,Emad Tajkhorshid & Eric Gouaux
Nature (2016) doi:10.1038/nature19367
*verbonden aan de Universiteit Utrecht
Dit onderzoek sluit nauw aan bij het strategische onderzoeksthema Life Sciences van de Universiteit Utrecht

