Wat bepaalt het lot van een cel?
Tweede ERC Advanced Grant voor Piet Gros

De European Research Council heeft voor de tweede keer aan prof. Piet Gros van de Universiteit Utrecht een ERC Advanced Grant toegekend. De toekenning van bijna 2,5 miljoen euro stelt hem in staat een belangrijke volgende stap te zetten in zijn onderzoek naar ons immuunsysteem. Gros wil uitzoeken hoe ons lichaam bepaalt of een cel wel of niet gezond is, en dus beschermd of juist afgevoerd moet worden. Problemen met de afvoer van zieke cellen blijken bij steeds meer aandoeningen een rol te spelen. Over de herkenning van zieke cellen, de cruciale eerste stap dit proces, is echter nog weinig bekend.
Piet Gros is een pionier in het onderzoek naar het complementsysteem. Dit is bij mensen en dieren de aangeboren eerste verdedigingslinie tegen ziekteverwekkers. “Toen ik vijftien jaar geleden aan dit onderzoek begon, trok een sessie over het complementsysteem op het grootste internationale immunologie-congres een tiental onderzoekers. Nu zijn dat er vaak honderden”, vertelt Gros. Zijn baanbrekende onderzoek leverde hem in 2010 de NWO Spinozapremie op, de hoogste Nederlandse onderscheiding in de wetenschap. Voor zijn grote bijdrage aan het begrijpen van het complementsysteem, ontvangt hij bovendien 13 april aanstaande de Gregory Aminoff Prize in Crystallography 2018 van de Koninklijke Zweedse Academie voor Wetenschappen.
Lot van de cel
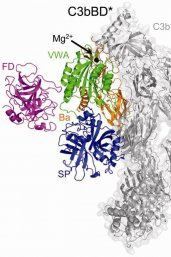
Het complementsysteem bestaat uit ruim dertig (grote) eiwitten die via een kettingreactie ziekteverwekkers uitschakelen en zieke cellen afvoeren. Het lot van de cel wordt bepaald door de interactie tussen het complementsysteem en de cel zelf. Als het complementsysteem zichzelf aan een cel weet te binden, betekent dat het einde van de cel. Maar als het de cel lukt die binding te voorkomen, blijft de cel leven. Over deze interactie tussen het complementsysteem en de cel, is echter nog zeer weinig bekend.
Cruciale vraag
“Wat ik mij realiseerde is we inmiddels veel meer weten over het complementsysteem, maar niet wát nou voor de betrokken eiwitten bepaalt of een cel wel of niet gezond is. Terwijl dat een cruciale en biologisch zeer relevante vraag is”, vertelt Gros. Van steeds meer aandoeningen wordt namelijk ontdekt dat de werking van het complementsysteem ontregeld is.
Biologisch belang veel groter
Het gaat dan mis bij het onderscheid tussen gezonde en zieke cellen, waardoor het complementsysteem gezonde cellen laat afvoeren. Van reuma, bacteriële infecties en ouderdomsblindheid was dat al vrij lang bekend, maar inmiddels is dit ook vastgesteld voor onder meer de afstoting van getransplanteerde organen en voor weefselschade na een hartinfarct of hersenbloeding. Recent zijn daar schizofrenie, de ziekte van Alzheimer en de verlammende en levensbedreigende vorm van het Guillain-Barré syndroom bijgekomen. “Het biologische belang van het complementsysteem blijkt dus veel groter dan de eerste verdediging tegen virussen en bacteriën”, licht Gros toe.
Nieuwe uitdaging
Die selectie van ziek of gezond moet plaatsvinden op basis van iets dat zich aan de buitenkant van de cel bevindt, in het celmembraan, en Gros heeft een idee van waar hij naar op zoek moet. Maar het onderzoek naar moleculaire processen in het celmembraan is voor hem een hele nieuwe uitdaging.
Beeldvormingstechnieken
Zo’n celmembraan wordt bevolkt door eiwitten, suikers en lipiden die wisselende interacties aangaan, bijvoorbeeld om stoffen in of uit de cel te transporteren. Gros: “Tot nu toe was het erg moeilijk om hier onderzoek naar te doen, vanwege de enorme verschillen in de lengteschalen van die interacties. Van enkele Ångströms voor atomaire interacties tot tientallen nanometers voor interacties tussen eiwitcomplexen. Dat is een factor 100 verschil. Maar de geweldige ontwikkelingen in beeldvormingstechnieken maken het nu mogelijk om de interacties op al die verschillende lengteschalen in beeld te brengen.”
Science-publicatie
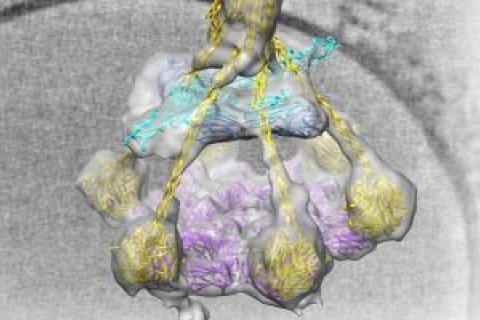
Het onderzoek van Gros is alleen mogelijk door voortdurende innovaties en slimme combinaties van beeldvormingstechnieken. Zo verscheen in februari een publicatie in het tijdschrift Science van Gros en collega’s van het Leids Universitair Medisch Centrum over hoe ze met een nieuwe methode een belangrijke ‘aan-schakelaar’ van het complementsysteem in beeld hebben gebracht. Voor dit ERC-project zal hij voortborduren op het onderzoek van zijn Utrechtse collega Gerrit van Meer en onder meer samenwerken met zijn Utrechtse collega’s prof. Antoinette Killian (membraan biochemie en biofysica), dr. Lukas Kapitein (fluorescentiemicroscopie) en prof. Friedrich Förster (cryo-elektronenmicroscopie en cryo-elektronentomografie).
Lees meer
- Science-publicatie februari 2018: Vrieskou onthult verrassende schakel in ons immuunsysteem
- Bèta’s in Beeld: Piet Gros over zijn onderzoek naar het complementsysteem
- Twee prestigieuze internationale prijzen voor Piet Gros
Dit onderzoek maakt deel uit van het interdisciplinaire onderzoeksprogramma Life Sciences van de Universiteit Utrecht, in het bijzonder van Science for Life

