Structuur helder van eiwit dat zenuwcel en myeline verbindt
Publicatie Nature Communications
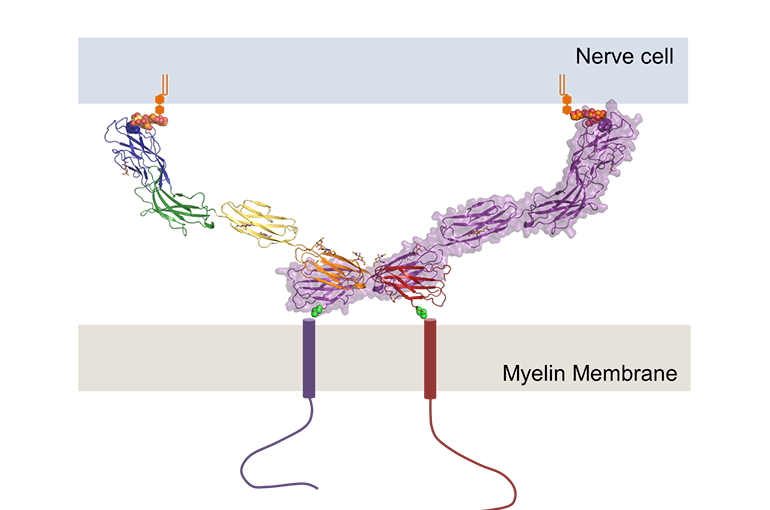
Utrechtse onderzoekers hebben de structuur opgehelderd van een eiwit dat zorgt voor verbinding tussen zenuwcellen en de cellen die de beschermende laag vormen die daar omheen zit. Dit eiwit, MAG, zorgt ook voor informatie-uitwisseling tussen deze cellen. Omdat MAG betrokken is bij het herstel van zenuwcellen, kan deze kennis van pas komen bij de zoektocht naar behandeling van ziekten waarbij het zenuwstelsel is beschadigd. De onderzoekers publiceren hun bevindingen op 6 december 2016 in Nature Communications.
Om te zorgen dat zenuwen in ons zenuwstelsel hun signalen snel genoeg kunnen doorgeven, worden ze omringd door een vettige substantie die myeline heet. Het eiwit myeline-geassocieerd glycoproteïne (MAG) speelt een belangrijke rol bij de vorming en instandhouding van dit myeline. Het bevindt zich tussen de celmembranen van zenuwcellen en van de myelinevormende cellen. Bij schade aan zenuwcellen, bijvoorbeeld door een dwarslaesie of een beroerte, remt MAG actief het herstel.
“Als je het eiwit uit zou kunnen zetten, zou je misschien de regeneratie van zenuwweefsel kunnen bevorderen”, zegt Bert Janssen, scheikundige bij Kristal- en Structuurchemie en leider van het onderzoek. “Vandaar dat wij geïnteresseerd zijn in de precieze structuur van MAG.”
Als je het eiwit uit zou kunnen zetten, zou je misschien de regeneratie van zenuwweefsel kunnen bevorderen.
Driedimensionale structuur
Promovendus Matti Pronker en onderzoeksleider Bert Janssen bestudeerden MAG-eiwitkristallen met röntgendiffractie. Zo legden zij de driedimensionale structuur bloot van het gedeelte dat de twee celmembranen overbrugt. Uit deze structuur konden ze afleiden hoe MAG suikergroepen aan het oppervlak van de zenuwcel herkent en hieraan bindt.

Bovendien bleek dat een MAG-molecuul zich koppelt aan een tweede MAG-molecuul en zo een dimeercomplex vormt. Die koppeling bevindt zich op het celmembraan van de myelinevormende cel. Door de dimeervorming aan de ene kant van het molecuul en binding van suikermoleculen aan de andere kant is MAG in staat de afstand tussen de twee cellen te regelen. “Het zit als een soort rigide stokje tussen de twee cellen en houdt die op een afstand van ongeveer 10 nanometer”, aldus Bert Janssen, die dit werk uitvoerde met de Vidi-beurs van NWO die hij in 2012 ontving.
Signaaluitwisseling
De scheikundigen laten daarnaast zien dat de dimeervorming belangrijk is voor communicatie tussen de zenuwcel en de myelinevormende cel. Janssen: “De dimeer gaat door het celmembraan van de myelinevormende cel heen en kan zo dus boodschappen doorgeven aan die cel.”
In samenwerking met onderzoekers van het UMC Utrecht konden ze vervolgens in celkweken aantonen dat zowel de dimeervorming als de binding aan de suikermoleculen van belang zijn voor de uitgroei van zenuwcellen.
Publicatie
Matti F. Pronker, Suzanne Lemstra, Joost Snijder, Albert J.R. Heck, Dominique M.E. Thies-Weesie, R. Jeroen Pasterkamp and Bert J.C. Janssen.
Structural basis of myelin-associated glycoprotein adhesion and signalling.
Nature Communications, 6 dec 2016. Doi: 10.1038/NCOMMS13584

