Een nieuw stukje in de puzzel van kankeronderzoek
Publicatie in Science Advances
Wetenschappers van de Universiteit Utrecht bieden een nieuwe verklaring voor een van de raadsels op het gebied van kankeronderzoek. Verlies van vaak gemuteerde tumoronderdrukkende genen blijkt twee tegenovergestelde effecten te hebben: het kan de celproliferatie bevorderen of juist leiden tot een stopzetting van de celdeling, afhankelijk van de mate van genverlies. Deze observaties ondersteunen het idee dat alleen mutaties die de genen onvolledig inactiveren een selectief voordeel opleveren voor kankercellen. De onderzoekers publiceren hun resultaten op 20 mei in Science Advances.
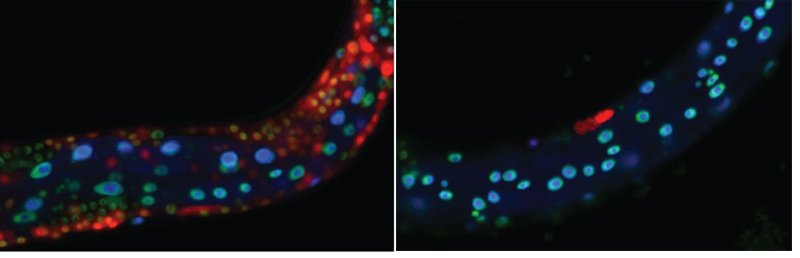
Mutaties in zogenaamde SWI/SNF-genen komen veel voor bij humane kanker, maar het spectrum van deze mutaties is ongebruikelijk: het gaat geregeld om inactivering van slechts één van de twee exemplaren van het gen. In de nieuwe studie toont de groep van Sander van den Heuvel (afdeling Biologie, IBB) aan dat SWI/SNF-verlies twee tegengestelde uitkomsten kan hebben, afhankelijk van de mate van het functieverlies.
Verlies van tumoronderdrukkende genen kan twee tegengestelde uitkomsten hebben.
"Gedeeltelijk functieverlies leidt tot tumorgroei en belemmert de celdifferentiatie, terwijl volledige inactivatie resulteert in een acute stopzetting van de celproliferatie. Deze observaties ondersteunen ons idee dat alleen mutaties die de SWI/SNF-componenten onvolledig inactiveren een selectief voordeel bieden voor kankercellen. Dergelijke mutaties elimineren een tumoronderdrukkende activiteit, maar laten de essentiële rol van het SWI/SNF-complex intact", legt de laatste auteur Sander van den Heuvel uit.
Opmerkelijk is dat 20 procent van alle humane kankers mutaties bevatten die de SWI/SNF-eiwitcomplexen beïnvloeden, zoals pas recentelijk is ontdekt. Er zijn verschillende verklaringen geopperd om het ongewone patroon van SWI/SNF-mutaties te verklaren. Een van de mogelijkheden is dat het gemuteerde eiwit leidt tot SWI/SNF-complexen met abnormale activiteiten, een andere verklaring is dat het gemuteerde eiwit het normale eiwit inactiveert, of dat de functie van SWI/SNF-complexen dosisafhankelijk is.
Dosisafhankelijk
De Van den Heuvel-groep biedt nu een sterke ondersteuning voor dosisafhankelijke functies, gebaseerd op een systematische analyse van de functie en deregulering van SWI/SNF-genen in een diermodel, de nematode Caenorhabditis elegans. Een eerdere studie van de groep bracht een sterke tumoronderdrukkende rol van het SWI/SNF-complex in dit dier aan het licht. "De kracht van onze aanpak is dat het effect van het muteren van verschillende SWI/SNF-componenten kan worden onderzocht in hetzelfde celtype en tijdens goed gedefinieerde momenten in de ontwikkeling ", aldus Van den Heuvel.
De huidige studie onderzocht de bijdrage van verschillende eiwitten van het SWI/SNF-complex door middel van verschillende technieken, waaronder induceerbare genmanipulatie op basis van CRISPR/Cas9-technologie. Onder goed gecontroleerde omstandigheden gedroegen de verschillende SWI/SNF-componenten zich allemaal hetzelfde: verminderde functie leidde tot overproliferatie, en volledige inactivatie juist tot het stopzetten van celdeling.
Ongewoon patroon
De bevindingen verklaren waarom een ongewoon patroon van genmutaties wordt gevonden in humane kanker. “De kankercellen kunnen niet zomaar de SWI/SNF-genen verliezen; er worden mutaties geselecteerd die het complex gedeeltelijk inactiveren, zodat de tumoronderdrukkende activiteit verloren gaat terwijl de kritische functie intact blijft. Dat geeft ook aan dat de afhankelijkheid van de resterende SWI/SNF-functie kan worden benut om de uitbreiding van SWI/SNF-mutantkankercellen te voorkomen", aldus Van den Heuvel. "Gezien de overeenkomsten tussen SWI/SNF-gemuteerde wormen en menselijke kankercellen, kunnen verdere genetische studies in dit diermodel helpen bij het ontdekken van kwetsbaarheden van SWI/SNF-gemuteerde tumorcellen, die uiteindelijk kunnen bijdragen aan zeer specifieke anti-kanker therapieën".
Publicatie
Dose-dependent functions of SWI/SNF BAF in permitting and inhibiting cell proliferation in vivo. Science Advances, 20 mei 2020. Aniek van der Vaart* , Molly Godfrey*, Vincent Portegijs*, Sander van den Heuvel*.
*Auteurs verbonden aan de Universiteit Utrecht

